Электрохимия занимается изучением спонтанных химических реакций для производства электричества и использованием электричества для ускорения несамопроизвольных химических реакций.
Электрохимии является филиалом химии, которая изучает феномен переноса электрона для химического превращения энергии в электрическую энергию и наоборот. Электродный потенциал металлов изучал русский ученый Н. И. Бекетов, который составил ряд напряжений металлов.
Электрохимические реакции
Реакции с переносом электрона называются окислительно-восстановительными реакциями, поскольку в них одновременно протекают восстановление и окисление. Химические вещества, которые теряют электроны, подвергаются. С другой стороны, химический элемент, который получает эти электроны, подвергается восстановлению, и его степень окисления становится меньше.
Например, ниже представлена реакция этого типа, в которой металлическую цинковую пластину (Zn0) помещают в раствор сульфата меди (в котором растворены катионы меди II (Cu2+ )). Цинк подвергается окислению, теряя два электрона и становясь катионом цинка (Zn2+), в то время как ионы меди получают эти электроны и превращаются в металлическую медь (Cu0).
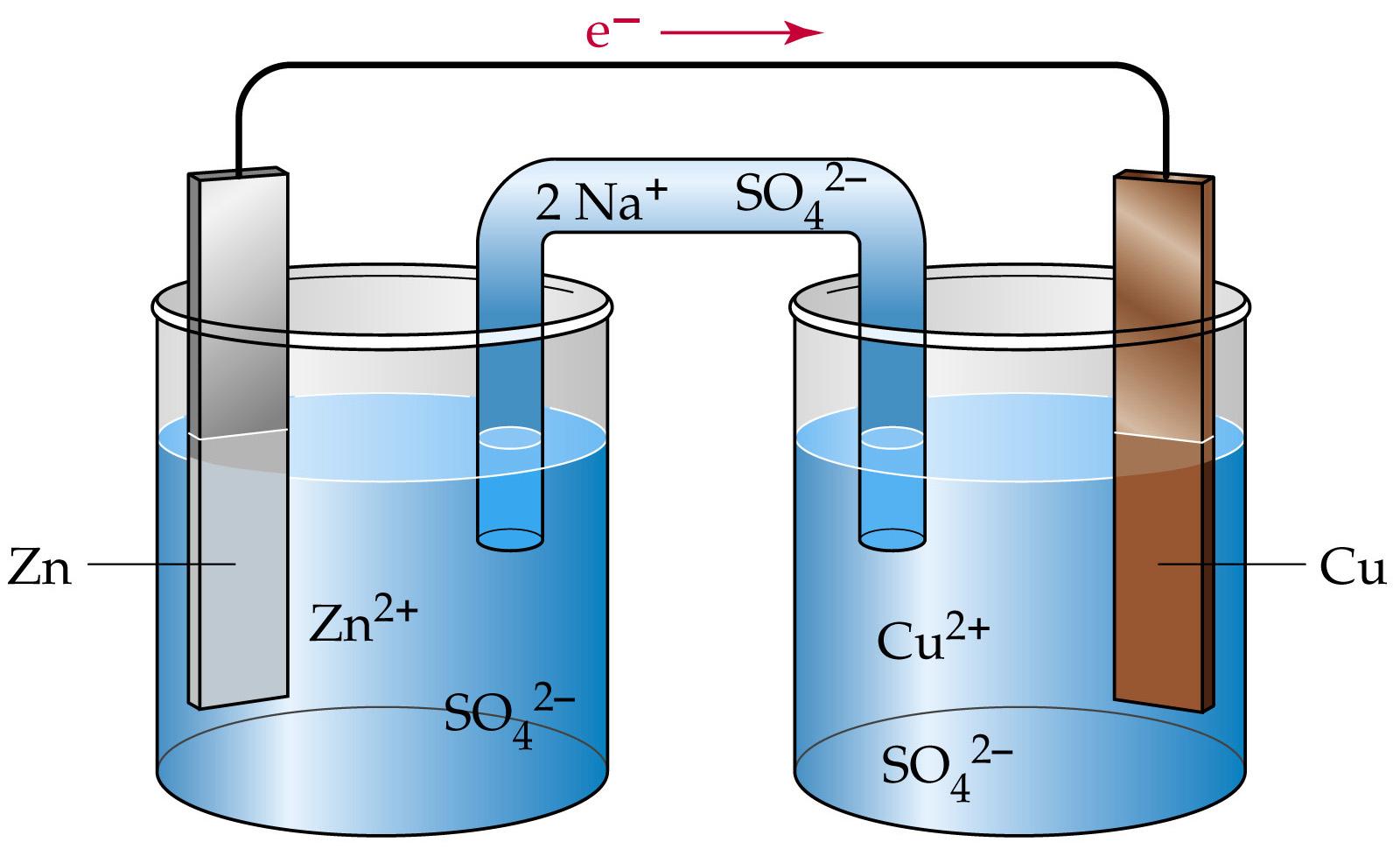
Таким образом, в электрохимических явлениях всегда происходят реакции, подобные этой. Однако это может произойти двумя способами.
Области применения электрохимии
Есть две основные области применения этой науки.
Элементы и батареи: в этом случае происходит преобразование химической энергии в электрическую, то есть спонтанные окислительно-восстановительные химические реакции используются для выработки электричества.
Внутри находятся определенные химические вещества, которые самопроизвольно реагируют, передавая электроны, то есть посредством окислительно-восстановительных реакций. Батареи имеют два электрода:
- анод: отрицательный полюс, где происходит окисление;
- катод: положительный полюс, где происходит восстановление.

Элементы и батареи также содержат электролит, который представляет собой раствор с ионной проводимостью. Таким образом, между этими полюсами образуется поток электронов, который приводит к образованию электрического тока, который может использоваться для работы различных электрических устройств.
Разница между элементами и батареями заключается в том, что в то время как элементы имеют только два электрода, батареи образуются из нескольких элементов, соединенных последовательно или параллельно, то есть, они имеют несколько электродов, которые увеличивают их напряжение.
Электролиз: это обратный процесс, который происходит в элементах и батареях, то есть происходит преобразование электрической энергии в химическую. Электрическая энергия используется, чтобы вызвать несамопроизвольную химическую реакцию, нейтрализуя заряды ионов и образуя простые вещества.
Это происходит, когда электрический ток от генератора (такого как элемент или батарея) проходит через ионную жидкость (расплавленное вещество) или через водный раствор, содержащий ионы (электролиз в водной среде ). Таким образом, катион, присутствующий в жидкости или растворе, получает электроны, а анион отдает электроны, так что оба имеют нулевой электрический заряд и накопленную химическую энергию.
Электролиз используется для производства простых веществ важного применения, которые не встречаются в природе, таких как газообразный хлор и металлический натрий, образующиеся при электролизе хлорида натрия. При водном электролизе хлорида натрия, помимо производимого хлора, также получают газообразный водород, который используется в качестве топлива.
Электролиз также используется для производства металлов и для разработки процессов защиты металлов от коррозии.
Таким образом, электрохимия является очень важной областью не только потому, что она связана с технологическим развитием и методами производства электроэнергии, но и потому, что она даже позволяет контролировать деятельность мозга и сердца, pH крови, наличие загрязняющих веществ в воде и т.д. в дополнение к возможности создания спасательного оборудования, такого как кардиостимулятор и т. д.









